МАЛОИНВАЗИВНОЕ ЛЕЧЕНИЕ ГЕМОРРОЯ В "ЛАЗЕР КЛИНИКЕ"
<< Обратно к статьям ЭКСПЕРИМЕНТАЛЬНОЕ ОБОСНОВАНИЕ ВЫБОРА ДЛИНЫ
ВОЛНЫ ВЫСОКОИНТЕНСИВНОГО ЛАЗЕРНОГО ИЗЛУЧЕНИЯ ДЛЯ
МАЛОИНВАЗИВНОГО ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ
ХРОНИЧЕСКОГО ГЕМОРРОЯ
Шахрай С.В., Гаин Ю.М., Гаин М.Ю., Рябцева С.Н.
Государственное учреждение образования
«Белорусская медицинская академия последипломного образования»,
г. Минск, Республика Беларусь
цель работы, методы исследования, результаты, вывод.
Цель работы.
В эксперименте оценить морфологические изменения со стороны стенки прямой кишки при воздействии лазерного излучения 970 и 1560 Нм и на основании изучения репаративных процессов в тканях рекомендовать для практического использование оптимальную длину волны при разработке способа лазерной деструкции геморроидальных узлов.
Методы исследования.
Проведены эксперименты по оценке эффективности воздействия лазерного излучения диапазона 970 и 1560 Нм на ткани прямой кишки с последующей морфологической интерпретацией результатов. Моделирование этапов лазерной деструкции производили на белых рандобредный крысах. В работе использовали полупроводниковый лазер «Медиола-Компакт», ЗАО «Фотэк», Республика Беларусь. У первой группы животных воздействие производили лазерным излучением с длиной волны 970 Нм, во второй – 1560 Нм. Животных выводили из эксперимента на первые, седьмые и четырнадцатые сутки после начала эксперимента с оценкой морфологических характеристик фрагментов ткани с участками лазерной деструкции.
Результаты.
При сравнительной оценке гистологических изменений в зоне воздействия лазерным излучением на ткани дистального отдела прямой кишки с различной длиной волнового диапазаона на 1-е, 7-е и 14-е сутки от момента повреждения отмечено, что менее выраженные деструктивные нарушения и более раннее заживление наблюдается при воздействии лазерным лучом длиной волны 1560 Нм, нежели при длине волны 970 Нм.
Выводы.
1. Сравнительная гистологическая характеристика результата воздействия лазерного излучения на дистальный отдел прямой кишки экспериментальных животных показала, что менее выраженные некротические и дистрофические изменения в тканях и более раннее формирование грануляционно-фиброзной ткани с замещением поврежденных структур наблюдаются при использовании лазерного излучения длиной волны 1560 Нм.
2. При выборе волнового спектра лазерного излучения и режимов воздействия при разработке методик деструкции геморроидальной ткани прямой кишки приоритет следует отдавать водопоглощаемой длине волны 1560 Нм в инфракрасном диапазане светового спектра.
Современная хирургия имеет в своём арсенале широкий спектр высокотехнологического оборудования для выполнения диссекции, вапоризации и коагуляции тканей, что в значительной степени способствует модификации способов оперативного лечения заболеваний с чёткой тенденцией их трансформации в малоинвазивные вмешательства, способствующие быстрой реабилитации пациентов и скорейшему их возвращению к труду и полноценной жизни. В этой связи особо хочется отметить своеобразный ренессанс лазерной хирургии. Прогресс в расширении спектра применения лазерной хирургической техники стал возможен благодаря значительной модификации генераторов лазерного излучения и разработке нового инструментария. Появление полупроводниковых лазерных и свето-волоконных оптических систем доставки излучения в малодоступные анатомические зоны и тканевые пространства позволило значительно расширить спектральный волновой диапазон применяемого в медицине излучения, значительно уменьшить массу техники, качественно улучшить способы доставки энергии к источнику поглощения. При выполнении ряда хирургических вмешательств и манипуляций лазерные медицинские аппараты начали значимо конкурировать с коагуляторами и ультразвуковыми диссекторами, а по целому спектру методик сумели существенно их превзойти.
В последние годы в литературных источниках появилось значительное количество публикаций, пропагандирующих использование в аноректальной хирургии (в первую очередь, в хирургии геморроя) ультразвукового, лазерного, радиоволнового и плазменного оборудования, аппаратно-контролируемой биполярной коагуляции, модернизированных коагуляторных систем и т.д. [1, 2, 3]. Подавляющее большинство предлагаемых методик на практике являют собой принцип открытой или закрытой геморроидэктомии с одним лишь различием, диссекция тканей выполняется не острым механическим путем, а с использованием внешнего источника высоких энергий [3]. При этом многие хирурги утверждают о применении так называемого «идеального скальпеля». Выполнение геморроидэктомии с их использованием по наблюдениям авторов методик позволяет уменьшить интенсивность болевого синдрома в послеоперационном периоде, ускорить заживление ран, уменьшить частоту рецидивов заболевания. Однако само наличие раневого дефекта, сроки заживления которого варьируют в пределах 4.7 недель (в зависимости от способа диссекции), не обеспечивают максимально комфортного и короткого послеоперационного периода, что, несомненно, сказывается на качестве жизни пациента и не гарантирует от развития в этот период осложнений. В связи с этим, дальнейший поиск способов и методик деструкции геморроидальной ткани при хроническом геморрое с минимизацией негативных последствий послеоперационного раневого процесса и в настоящее время является актуальной задачей хирургии и колопроктологии.
Материалы и методы
В 2009 году авторы настоящего исследования впервые начали применять способы лазерной интерстициальной, трансмукозной или
субмукозной лазерной деструкции геморроидальных узлов в лечении хронического геморроя. Суть вмешательств сводилась к использованию
высокоинтенсивного лазерного излучения в качестве источника девитальзации тканей геморроидального узла с развитием эффекта «белой
денатурации» и последующим склерозированием очага. При этом световод лазерного аппарата погружали в ткани геморроидального узла, либо воздействовали на него контактно (в любом случаев лазерное излучения не использовали как скальпель для отсечения геморроидальных узлов). При разработке методики наиболее важным технологическим вопросом стал выбор длины волны лазерного излучения.
Лазерное излучение, попадая на биологическую ткань, может рассеиваться и поглощаться ею, отражаться от ткани или проходить сквозь
неё. На отражение приходиться от 30 до 70% энергии, поэтому наиболее эффективным способом доставки излучения в ткани становится не
дистанционное, а инвазивное (интерстициальное) воздействие (путём погружения источника излучения в объект воздействия). Степень
поглощения тканью лазерного излучения зависит от содержания в нём компетентных хромотофоров. Излучение полупроводникового лазерного, нашедшего в последнее время широкое применение в хирургии, лежит в инфракрасном диапазоне светового спектра, где наиболее значимыми хроматофорами являются молекулы воды, меланина и оксигемоглобина (рисунок 1).
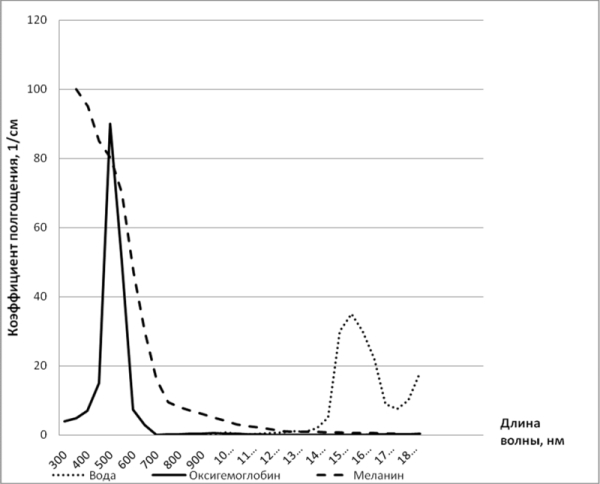
Рисунок 1. Спектр поглощения основных хроматофоров биологических тканей.
Коэффициент поглощения излучения в ткани имеет индивидуальные пиковые изменения у конкретного хроматофора и зависит от длины волны. Именно поэтому правильный выбор волнового диапазона лазерного излучения для выполнения конкретной лечебной задачи будет определять конченый результат воздействия.
У лазерного излучения с длиной волны 0,81–1,06 мкм хроматофором является гемоглобин. Коэффициент поглощения лазерного излучения водой в этом диапазоне примерно в 20 раз меньше, чем в гемоглобине. Последний в данной ситуации выступает в качестве звена, передающего поглощённую им энергию лазерного излучения воде [6]. Увеличение мощности излучения при воздействии на ткани в определённый момент может приводить к тому, что тепловая энергия, выделяющаяся в гемоглобине, не успевает передаваться
воде. Это вызывает карбонизацию ткани у торца световода. Происходит увеличение поглощения излучения и уменьшение области теплопоглощения с ускорением процесса разогрева. В результате происходит локальный перегрев конца световода и формирование обширной зоны некроза [7]. Помимо этого лазерное излучение будет слабо поглощаться раствором анестетика, введенного в ткани, вызывая локальную карбонизацию нервных окончаний и способствуя пролонгации болевого синдрома.
Таким образом, если преследовать цель стойкой девитализации ткани с минимальным эффектом карбонизации, то оптимально воздействовать
лазерным излучением с длиной волны 1,32 мкм и выше, максимальное поглощение которого осуществляется водой. Использование лазерной
энергии в этом случае позволяет получать желаемый результат при меньшей мощности излучения. При этом имеется эффективный способ защиты окружающих тканей за счёт создания водной подушки, которая будет поглощать энергию излучение, вышедшую за пределы желаемой зоны деструкции. Например, в растворе анестетика, в этом случае энергия меньше проникает в окружающие ткани, что в свою очередь снижает вероятность их карбонизации и способствует уменьшению болевого синдрома.
Ещё одним важным физическим аргументом в пользу применения водопоглощаемого спектра излучения является наличие эффекта
преодоления скрытой теплоты парообразования при испарении воды, энергетическая составляющая которого 2,25·106 Дж/кг. С учётом того, что теплоёмкость воды составляет 4200 Дж/(К·кг), для нагрева её от температуры тела до 100 ºС необходимо 2,65 · 105 Дж/кг энергии, что почти в 9 раз меньше количества энергии, необходимого для испарения воды. Именно поэтому локальная температура в зоне лазерной деструкции долго может удерживаться на уровне 100 ºС, что в 2,5-3 раза меньше температуры обугливания, ведущего к росту поглощения и сильному разогреву конца световода.
Для выбора длины волны в водопоглощаемом спектре и прогноза целевого эффекта физического воздействия на геморроидальную ткань
необходима оценка оптических свойств основных хроматофоров биоткани - воды и крови.
На рисунке 2 представлена зависимость коэффициента поглощения лазерного излучения в воде и оксигенированной цельной крови с
гематокритом 45% от длины волны, а также эффективный коэффициент ослабления излучения в крови с учётом его рассеивания [5, 8, 9].
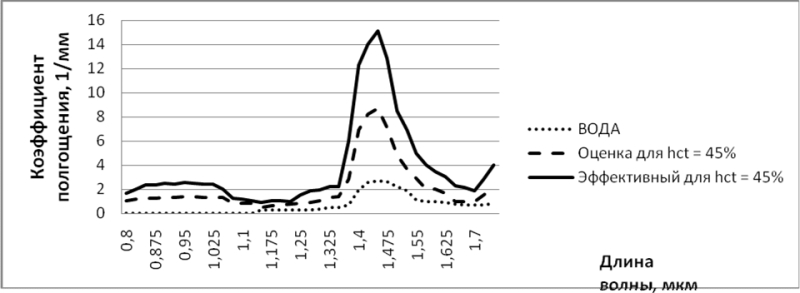
Рисунок 2. Спектры поглощения воды и цельной (гематокрит 45%) оксигенированной крови,а также эффективного коэффициента ослабления излучения в крови.
Из него следует, что отнесение к «водопоглощаемому» спектру излучения длиной волны 1,32 мкм является условным, поскольку его
поглощение содержащейся в крови водой составляет лишь малую часть суммарного поглощения. На излучение с длиной волны 1,47 мкм приходится локальный максимум его поглощения в воде. Однако при этой длине волны остаётся значительным поглощение в неводных составляющих крови. Это снижает уровень мощности излучения, при котором может начаться карбонизация ткани. Наилучшие спектральные показателя для достижения необходимого эффекта деструкции геморроидальной ткани могут быть получены при использовании лазерного излучения с длиной волны 1,5 мкм и более, например 1,56 мкм [4, 10].
Для оценки теоретических выводов нами проведены эксперименты по оценке эффективности воздействия лазерного излучения диапазона 970 и 1560 Нм на ткани прямой кишки с последующей этапной временной морфологической интерпретацией результатов.
Моделирование этапов лазерной деструкции тканей прямой кишки осуществляли на белых рандобредный крысах мужского пола массой
224,5±20,2 г. Эксперимент проведен на 2 группах животных (по 18 крыс в каждой). В работе использовали полупроводниковый лазер «Медиола-Компакт», ЗАО «Фотэк», Республика Беларусь). После взвешивания животному под внутримышечным наркозом (введением комбинации 2 мл 0,25%-ного раствора дроперидола и 1 мл 0,005%-ного раствора фентанила из расчёта 0,35 мл на 100 г веса) производили лазерную деструкцию тканей в области дистального отдела прямой кишки. С этой целью волоконным гибким световодом с толщиной оптической жилы 100 мкм на границе слизистой и кожи наносили перфорационные отверстия с дальнейшим проведением световода в подслизистый слой по оси кишки на протяжении 1 см. Далее световод извлекали из подслизистого слоя кишки со скоростью 0,5 см в секунду в импульсном режиме лазерного излучения равной длины эмиссии и паузы по 0,1 секунде и мощностью 3 Вт, при этом выполнялась лазерная деструкция ткани. Расстояние между каждой линией деструкции ткани (каждым первичным перфорационным отверстием в анодерме
соответственно) составляло 0,5 см, процедура деструкции по описанной методике выполнена этапно по всей окружности прямой кишки. У первой группы животных воздействие производили лазерным излучением с длиной волны 970 нм, во второй – 1560 нм. Животных выводили из эксперимента по четыре особи в каждой группе однократным введением 3%-го тиопентала натрия (трёхкратная разовая передозировка барбитурата) на первые, седьмые и четырнадцатые сутки после начала эксперимента с изъятием прямой кишки и тканей параректальной области. Экспериментальные исследования проводили в полном соответствии с современными принципами биоэтики, в том числе, «Европейской конвенцией по защите прав позвоночных животных» (принятой в г. Страсбурге 18 марта1986 года) и «Всемирной декларацией прав животных» («Universal Declaration of Animal Rights», принятой Международной Лигой Прав Животных в 23 сентября 1977 года в Лондоне и объявленной 15 октября 1978 года в штабе ЮНЕСКО в г.Париже).
Для оценки морфологических характеристик фрагментов ткани с участками лазерной деструкции материал после извлечения из тела крысы
фиксировался в формалине в течение 24 часов. После промывки в проточной воде проводилась вырезка фрагментов ткани размерами 1х1х0,5 см в следующем порядке: из зоны кожного дефекта, на 1 см и 2 см от первого и в зоне кишечного дефекта. Далее фрагменты ткани помещались в кассеты для приготовления парафиновых блоков. Методика заключения материала в парафин включала: проводку в спиртах возрастающей концентрации в течение 24 часов (четыре смены), помещение в ксилол на 1,5 часа (3 смены по 30 минут), ксилол-парафин на 40 минут, на заключительном этапе помещение в парафин (первый – на 1 час 20 минут, второй – на 2 часа) и формирование парафиновых блоков. Далее из парафиновых блоков, содержащих фрагменты ткани, делались срезы толщиной 3-4 мкм, которые с целью депарафинизации и обезвоживания помещались в две смены ксилола, затем проводились по спиртам возрастающей концентрации, после чего промывались в дистиллированной воде и окрашивались гематоксилином в течение 1 часа и 30 минут. Затем проводилась промывка в проточной воде (2-
3 минуты) и помещение срезов в эозин на 40 секунд. После промывки в спиртах и проведения в ксилолах (две смены по 20 минут, третья – в течение 1 часа) срезы заключали под покровное стекло с помощью бальзама. На светооптическом уровне проведена оценка гнойно- некротических и репаративных процессов в зоне воздействия с использованием микроскопа фирмы “Leica”. Также выполнено морфометрическое измерение зон поражения с помощью цветной видеокамеры “DMLS” и программного обеспечения “Qwin Leica” (команда «Вектор»). При этом в каждой подгруппе анализу подвергались участки кишки и окружающей клетчаткой с наибольшей зоной поражения. При увеличении микроскопа х50 в 10 полях зрения выполнено по 10 измерений общей глубины поражения, которая включала гнойно- некротические и репаративные изменения, а также зоны коагуляционного некроза отдельно.
Статистическая обработка данных проводилась с использованием программы STATISTICA 6.0. Выполнялся расчет показателей среднего
значения, стандартного отклонения, минимального и максимального значения (Me.Sd, min-max). Различия между группами оценивались на
основании непараметрического U-критерия Манна-Уитни. Взаимосвязь между показателями определялась методом непараметрического
коэффициента корреляции Спирмена (rs), различия считались статистически значимыми при уровне достоверности р<0,05.
Результаты и обсуждение
В первые сутки после воздействия лазером в обеих группах исследования в мягких параректальных тканях отмечалось формирование зон
неполного некроза без перифокальной воспалительной реакции. У всех животных наибольшему воздействию подверглась стенка кишки с
преимущественным поражением подслизистого слоя. При этом в зоне воздействия луча длиной волны 970 Нм зона некроза не распространялась за пределы подслизистой оболочки (рисунок 3А). При воздействии лазерного луча длиной волны 1560 Нм зона отмечалось поверхностное поражение мышечного слоя стенки кишки (рисунок 3Б). Ввиду минимальных морфологических различий в группах морфометрическое исследование в данные сроки поражения не проводилось.
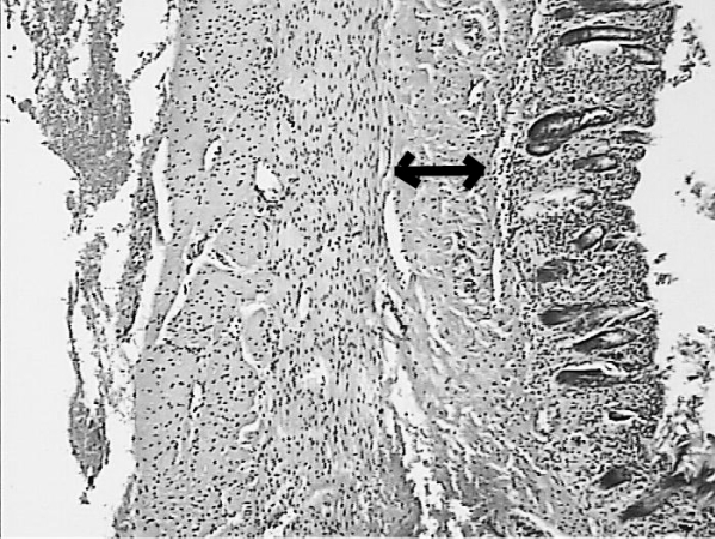
Рисунок 3. Зона некроза подслизистого слоя стенки кишки при воздействии
лазерного луча длинной 970 Нм (А).
Окраска гематоксилином и эозином.
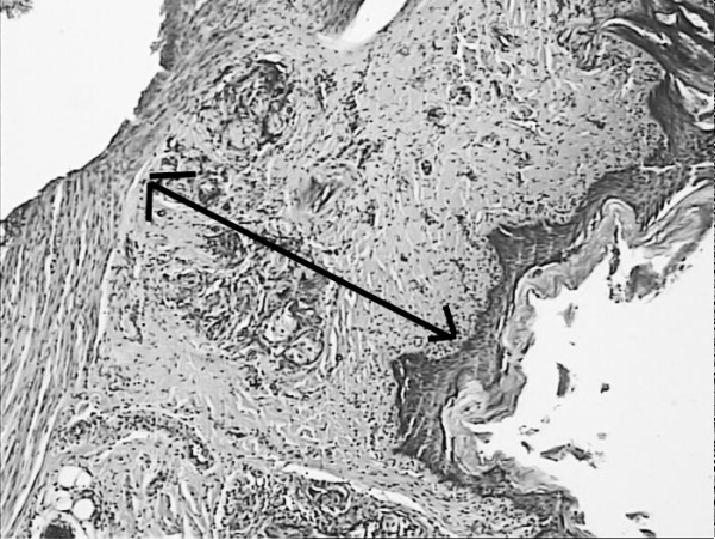
Рисунок 3. Зона некроза подслизистого слоя стенки кишки при воздействии
лазерного луча длинной 1560 Нм (Б).
Окраска гематоксилином и эозином.
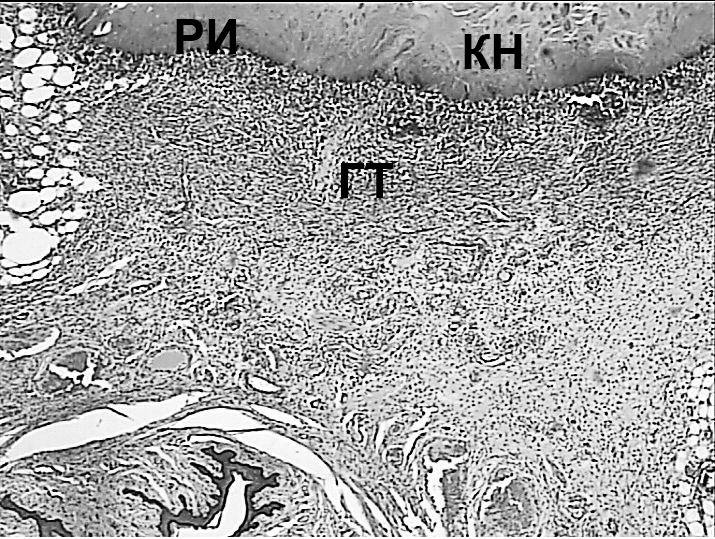
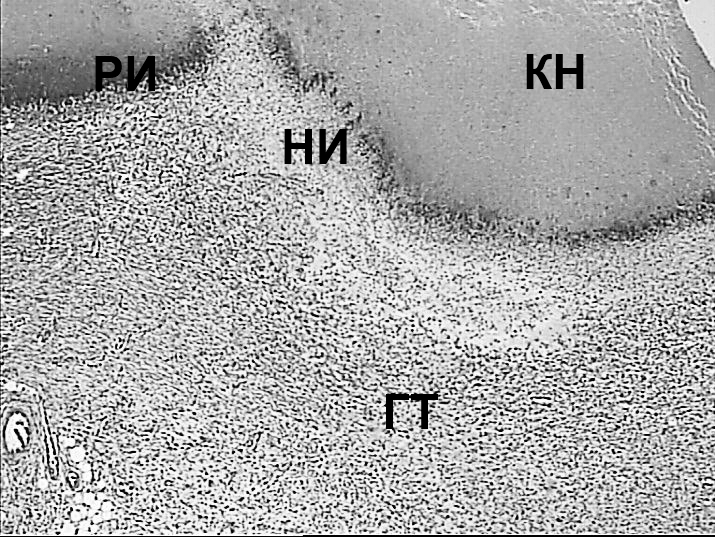
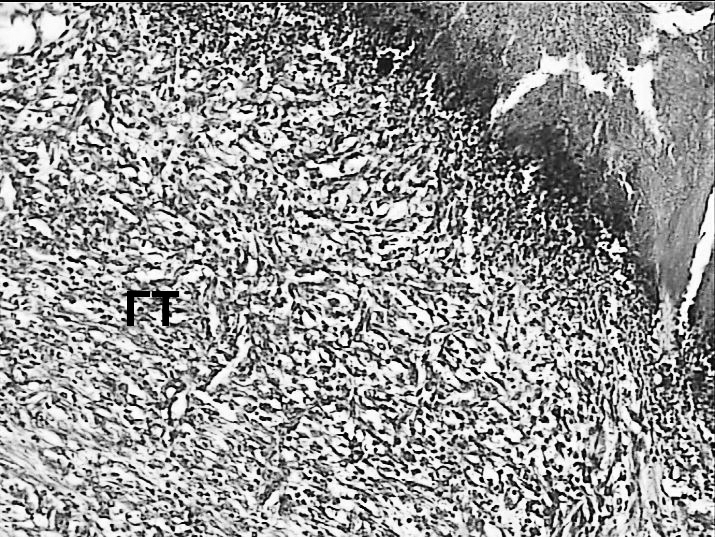
Через 7 суток после воздействия в зоне повреждения в каждой группе отмечались различные изменения (при этом внутригрупповых различий не отмечено). При лазерном воздействии лучом длиной волны 970 Нм выявлены зоны массивного коагуляционного некроза (КН) в области слизистой оболочки прямой кишки с выраженной реактивной гнойной инфильтрацией (ГИ) и наличием (или без) участков некробиотических изменений (НИ), представленных воспалительным отёком тканей с признаками расстройства кровообращения различной степени выраженности (рисунки 4А, 4Б). По периферии отмечалось формирование грануляционной ткани (ГТ) с элементами фиброзирования (рисунок 4В). Вся стенка кишки была вовлечена в этот процесс. Грануляционная ткань (ГТ) с воспалительной инфильтрацией была выявлена во всех слоях кишечной стенки и в окружающей клетчатке, при этом выраженность воспалительной инфильтрации убывала по мере удаления от зоны коагуляционного некроза (рисунок 4Г). Поперечно-полосатая мускулатура области наружного сфинктера также имела признаки некробиотически-дистрофических изменений, что проявлялось потерей исчерченности и гомогенизацией цитоплазмы миоцитов (рисунок 4Г).
Признаков замещения повреждённых структур фиброзной тканью не было выявлено. Средний размер зоны поражения составил 2545,69±47,81 (2238,15-2825,1) мкм, включая зону некроза - 920,59±38,48 (777,25-1157,77) мкм. Последняя составила 36,2±1,3% от общей зоны поражения.
(A)х50
(Б)х100
(В)х200
(Г)х50
Рисунок 4. Массивный некроз стенки прямой кишки (А) при воздействии лазером с длинной волны 970 Нм с некробиотическими изменениями (Б) и
разрастаниями грануляционной ткани (В) по периферии зоны некроза, перифокально – некробиотические изменения миоцитов поперечно-
полосатой мускулатуры (Г, указано стрелкой). Окраска гематоксилином и эозином.
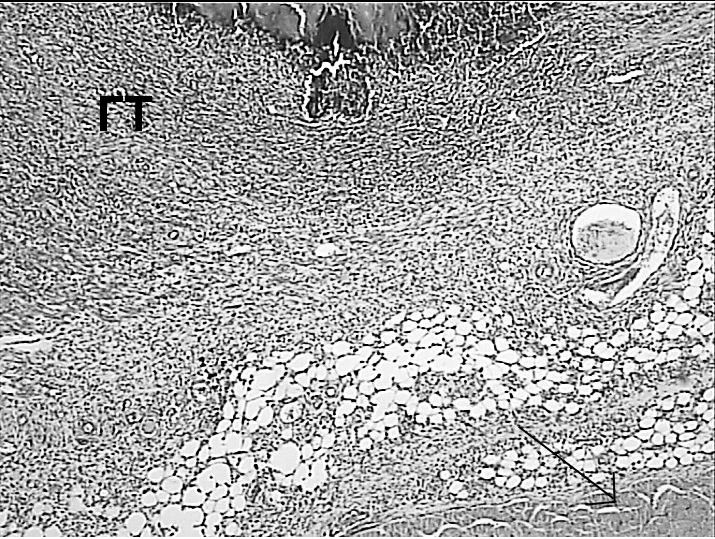
На 7-ые сутки после воздействия лазерным лучом длиной волны 1560 Нм мкм отмечалось наличие незначительной зоны некроза с выраженным перифокальным воспалительным валом, но без очагов некробиотических изменений с характерным отеком и/или кровоизлияниями. В исследованных участках прямой кишки выявлена тонкая зона коагуляционного некроза, которая располагалась на границе мышечной оболочки кишки и окружающей клетчатки (рисунок 5А). Зона некроза была окружена воспалительным валом, более выраженным по сравнению с воздействием лазера длиной волны 970 Нм (рисунок 5А). Отмечался некроз миоцитов поперечно-полосатой мускулатуры (рисунок 5Б), которые в близлижащих отделах к некрозу были окруженны грануляционной тканью с воспалительной инфильтрацией. По
мере удаления от точки воздействия лазерного луча отмечались признаки регенерации поврежденных структур, что проявлялось в лизисе миоцитов и замещением их фиброзной тканью (рисунки 5В, 5Г). Средний размер зоны поражения был 2231,99±15,48 (2144,65–2344,57) мкм, включая зону некроза –219,59±38,96 (61,26–470,85) мкм, которая составила 9,8±1,7% от общей зоны поражения.
(А)х50
(Б)х100
(В)х50
(Г)
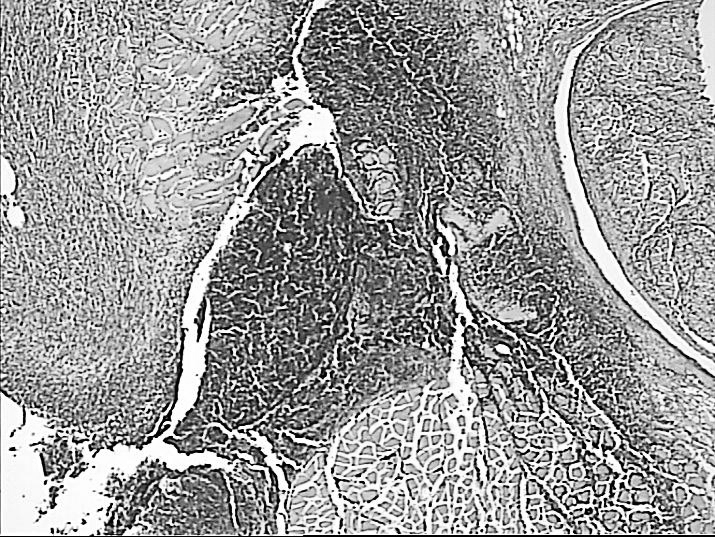
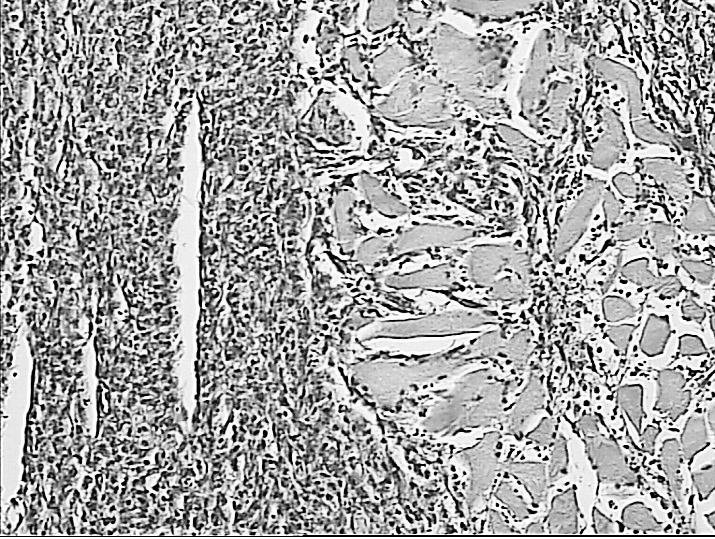
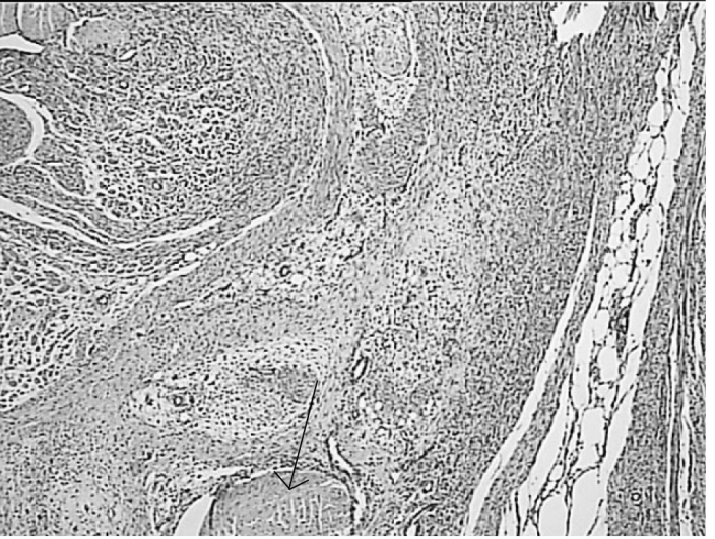
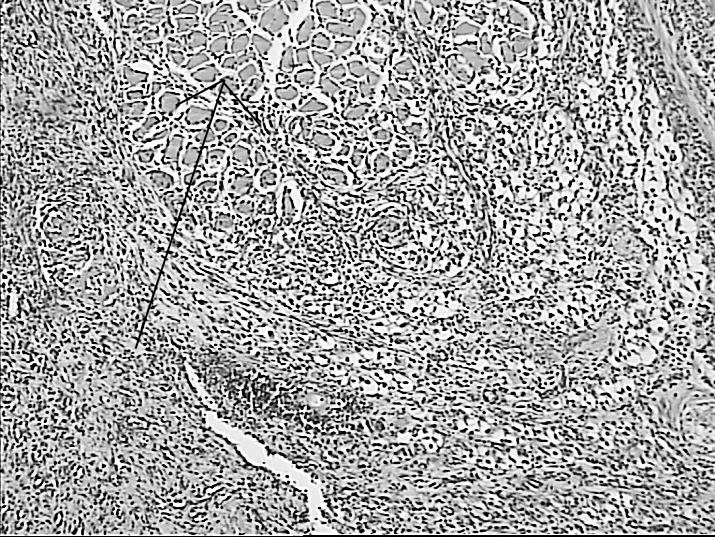
Рисунок 5. Регенеративные изменения в зоне воздействия лазерным лучом длинной волны 1560 Нм: очаг коагуляционного некроза окружен
лейкоцитарным валом (А), некроз миоцитов, окруженных грануляционной тканью (Б), лизис некротизированных миоцитов (указано стрелкой) и замещение их фиброзной тканью по периферии зоны воздействия (В, Г). Окраска гематоксилином и эозином.
К 14-ым суткам в зоне воздействия лазерным лучом длиной волны 1560 Нм отмечалось замещение повреждённых структур подслизистого слоя дистального отдела прямой кишки грануляционно-фиброзной тканью (рисунок 6А). При этом средняя глубина поражения составила
1315,51±127,58 (564,37–1844,7) мкм, некротические изменения отсутствовали. Зона воздействия лазерным лучом длиной волны 970 Нм к 14-
ым суткам была представлена очагами гнойно-некротических масс с перифокальным формированием грануляционной ткани и признаками
единичных очагов фиброзирования. Средняя глубина поражения составила 2487,27±30,03 мкм (2286,52–2615,47 мкм), некротических изменений –359,35±17,51 (270,0–474,07) мкм. В области поперечно-полосатой мускулатуры наружного сфинктера были выявлены некробиотические изменения в сочетании с репаративными процессами (рисунок 6Б).
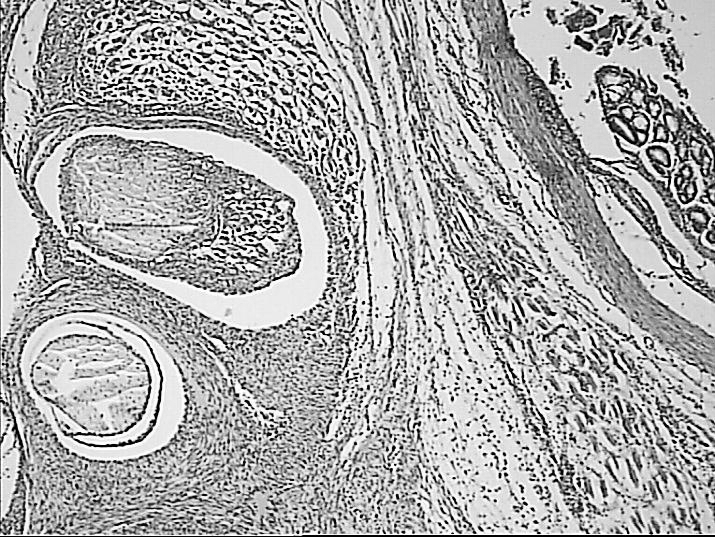
(А)х50
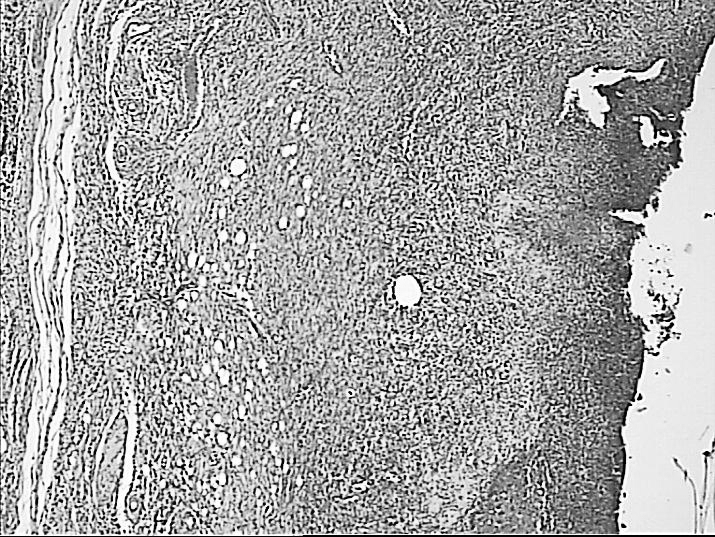
(Б)х50
Рисунок 6. Фиброзная трансформация зоны повреждения при воздействии лазерным лучом длинной 1560 Нм без очагов некроза и гнойного воспаления (А), очаги гнойно-некротических изменений с единичными участками фиброзирования при воздействии лазерным лучом длиной 970 Нм (Б). Окраска гематоксилином и эозином.
При статистической обработке полученных данных выявлены значимые различия по глубине поражения и наличию некроза в исследованных группах и подгруппах. В первой группе отмечалось снижение глубины некроза к 14 суткам по сравнению с седьмыми (U=0,0, р=0,00; rs=-
0,87, р=0,0) при статистически незначимом изменении общей глубины поражения (U=48,5, р=0,43; rs=-0,17, р=0,44). В отличие от второй группы исследования, где к 14 суткам (по сравнению с седьмыми) отмечается снижение как зоны некротических изменений (U=0,0, р=0,00; rs=-0,93, р=0,00), так и общей зоны поражения (U=0,0, р=0,00; rs=-0,87, р=0,00). При сравнительной анализе морфологических изменений, описаных для первой и второй групп выявлены статистически значимые отличия по глубине общей зоны поражения (U=3,5, р=0,00) и зоны некроза (U=0,0, р=0,00) как на седьмые, так и на 14-е сутки от момента повреждения. К 14-м суткам во второй группе отсутствовали некротические изменения (U=0,0, р=0,00), а зона общего поражения была представлена грануляционно-фиброзной тканью (U=0,00, р=0,00) по сравнению с первой группой, где сохранялись некротические изменения и выраженные воспалительные изменения.
Выводы:
1. В эксперименте при сравнительной оценке гистологических изменений в зоне воздействия лазерного излучения различной длины волны отмечено, что менее выраженные деструктивные изменения и более раннее заживление с формированием грануляционно-фиброзной ткани и замещением поврежденных структур наблюдаются при использовании лазерного излучения длиной волны 1560 Нм, нежели 970 Нм, о чём свитетельствует значительное уменьшение некротически-дистрофический изменений в тканях прямой кишки с 7-ых по 14-ые сутки в первой группе животных и фиброзная трансформация зоны повреждения.
2. При выборе волнового спектра лазерного излучения и режимов воздействия при разработке методик деструкции геморроидальной ткани прямой кишки приоритет следует отдавать водопоглощаемой длине волны 1560 Нм в инфракрасном диапазане светового спектра.
Литература:
1. Воробьёв Г.И. Основы колопроктологии. − Ростов-на-Дону: Издательство «Феникс», 2001. − 416 с.
2. Гейниц А.В., Елисова Т.Г. // Лазерная медицина. − 2009. − № 1. − С.31−35.
3. Кузьминов А.М., Борисов И.Ф. // Колопроктология. − 2009. − № 3.− С. 46-52.
4. Соколов А.Л., Лядов К.В., Стойко Ю.М. Эндовенозная лазерная коагуляция в лечении варикозной болезни. - М.: Медицина, 2007. − 220 с.
5. Kou L., Labrie D., Chylek P. // Appl. Opt. − 1993. − P. 3531.
6. Proebstle T.M. // Dermatol. Surgery. − 2002. − V. 28. № 7. − Р. 596.
7. Proebstle T.M. // Dermatol. Surgery. − 2005. − V. 31. № 12. − Р. 1678, discussion 1683.
8. Yaroslavsky A.N., Yaroslavsky I.N., Goldbach T. et al. // SPIE. − 1996.− V. 2678. − P. 314.
9. Roggan A., Friebel M., Dorschel K. et al. // Journal of Biomedical Optics. − 1999. − V. 4. № 1. − Р. 36.
10. Vanderkerchove P., Vuyisteke J. // 9th International Congress of Phlebology. − Bologna. 2008. − Р. 61.

